© 2004 Abimanyu D.
Nusantara
Posted:
Makalah Pribadi
Falsafah Sains (PPS 702)
Sekolah Pasca Sarjana
/ S3
Institut Pertanian
Bogor
Dosen:
Prof Dr Ir Rudy C
Tarumingkeng (Penanggung Jawab)
Prof. Dr. Ir. Zahrial Coto, M.Sc
Dr. Ir. Hardjanto, M.Sc
![]()
STRATEGI PRODUKSI
INOKULUM MIKORIZA ARBUSKULA BEBAS PATOGEN
o l e h:
E-061030132
![]()
“The study of plants without their mycorrhizas is the
study of artifacts.
The majority of plants, strictly speaking, do not have roots; they have
mycorrhizas.”
BEG-Committee, 25th May 1993
SUMMARY
Mycorrhiza is an association
between the roots of over 80% of all
terrestrial plant species and Zygomycete fungi from the Order Glomales. This
association has unique properties and functions for human being and ecosystem.
Mycorrhizal associations vary widely in structure and function, but the most
common interaction is the arbuscular mycorrhizal (AM) symbiosis. This
association confers benefits directly to the host plant's growth and development
through the acquisition of mineral nutrients from the soil by the fungus. In
addition, they may also enhance the plant's resistance to biotic and abiotic
stresses. A problem faced in utilizing AM symbiosis is in inoculums mass
production. Presently inoculums produced by the system which potentially
contaminated by pathogenic microorganisms through materials and equipments
used. In this review I propose three potentially strategies which can be use to
combat pathogenic microorganisms in mass inoculums production system, namely
avoidance, plant and mycorrhizal fitness, and refuse strategies. There is no,
however, single strategy which can fully satisfy to combat any pathogenic
microorganisms for a single mycorrhizal species. All strategies should be
considered as a single strategy which works concomitant or in array.
Keywords
: arbuscular mycorrhiza, inoculum production, mycorrhizal fitness
![]()
I. Pendahuluan
Mikoriza merupakan asosiasi antara tanaman dan
cendawan yang memiliki sifat dan peran yang unik bagi tanaman, manusia, dan
lingkungan hidup manusia. Struktur dan fungsi mikoriza sangatlah beragam, namun
hanya salah satu asosiasi yang paling sering ditemui, ditelaah, dikaji, dan
digunakan dalam dunia nyata yaitu asosiasi mikoriza arbuskula. Asosiasi ini
diketahui memiliki beraneka fungsi yang menguntungkan tanaman simbionnya,
misalnya meningkatkan serapan hara dan ketahanan terhadap cekaman abiotik dan
biotik. Tanaman yang dikolonisasi cendawan mikoriza arbuskula (CMA) akan lebih
bugar yang bermakna lebih tegar pertumbuhannya dan produksinyapun lebih tinggi
ditinjau dari aspek jumlah dan mutu. Namun demikian, berkah adanya cendawan
mikoriza arbuskula ternyata diiringi dengan kesulitan dalam produksi massal
inokulumnya. Membahas hakekat mikoriza sebagai benda yang maujud dan
kegunaannya sesungguhnya sama dengan membahas gatra ontologi CMA dalam perspektif
Falsafah Sains.
CMA merupakan
jasad renik yang bersifat obligat yaitu kelengkapan daur hidupnya ditentukan
oleh keberadaan inang dan kemampuan cendawan mengkolonisasi inang. Tanpa pasokan karbon dari inang kehidupan
CMA tidak akan lama. Sampai sekarang belum ada yang berhasil memproduksi
inokulum CMA secara in vitro. Belum
selesai dengan masalah produksi inokulumnya, belakangan diketahui pada
permukaan spora CMA ditemukan berbagai jenis bakteri. Sifat-sifat bakteri
tersebut belum diketahui, namun demikian ada sementara peneliti yang
berpendapat bahwa sebagian bakteri tersebut bersifat patogenik. Produksi
inokulum dengan menggunakan spora yang tidak bebas patogen sangatlah tidak
dianjurkan. Selain dari permukaan spora, patogen dapat tercampur dalam inokulum
melalui berbagai sumber, misalnya dari bahan dan alat yang digunakan dalam
produksi inokulum. Apapun dan darimanapun patogennya, tanaman inang tetap saja
berpeluang terinfeksi oleh patogen jika inokulum cendawan mikorizanya berpatogen.
Infeksi patogen pada akar tanaman jelas akan membuat tanaman inang menjadi
tidak bugar lagi.
Telaah ini ditulis sebagai salah satu bentuk
penugasan dalam Mata Kuliah Falsafah Sains. Tulisan ini disusun dengan tujuan
untuk memberikan telaah teoritis singkat mengenai strategi produksi inokulum
cendawan mikoriza arbuskula yang bebas patogen. Strategi tersebut disusun
berdasarkan pengalaman penulis dalam menekuni mikoriza ditunjang dengan
publikasi-publikasi yang gayut. Membahas strategi produksi inokulum CMA bebas
patogen, berdasarkan pemikiran yang mendalam dan digabungkan dengan fakta-fakta
empiris, sesungguhnya merupakan kerangka
epistemologi dari CMA dalam perspektif Falsafah Sains. Dalam strategi ini akan dibahas
beberapa cara-cara dan prosedur-prosedur yang memungkinkan dihasilkannya
inokulum bebas patogen. Adapun manfaat membahas strategi-strategi, kerangka aksiologi dari CMA, yang dipaparkan dalam makalah ini adalah diperolehnya pengetahuan
tentang menghindarkan tanaman inang supaya tidak tertular patogen yang dibawa
oleh inokulum mikoriza. Tujuan akhirnya, kerangka teleologi dari CMA, adalah
didapatkannya simbiosis yang sehat yang mampu meningkatkan produktivitas
tanaman yang seterusnya meningkatkan kesejahteraan umat manusia.
II. Cendawan Mikoriza Arbuskular (CMA)
Mikoriza sebagai benda yang maujud pada
hakekatnya (gatra ontologi), sesuai dengan akar katanya yaitu myces dan rhiza, adalah struktur simbiotis
mutualisme yang dibentuk antara cendawan dan perakaran tamaman. Disebut
simbiosis mutualisme karena cendawan mikoriza, yang hidup di dalam sel akar,
mendapatkan sebagian karbon hasil fotosintesis tanaman dan tanaman mendapatkan
hara atau keuntungan lain dari cendawan mikoriza. Namun kemudian konsep mikoriza berubah
menjadi struktur yang merupakan kesatuan hubungan kerja antara cendawan dan
akar tanaman yang meningkatkan kebugaran salah satu atau kedua mitra (Read,
1999). Hubungan kerja yang dihasilkan dapat bersifat positif (mutualis),
netral, ataupun negatif (parasitik). Dari takrif (definition) demikian
jelas bahwa mikoriza bukanlah cendawan, seperti yang selama ini dikelirukan
orang, yang benar mikoriza adalah asosiasi atau struktur kerja. Karena itu
penyebutan yang benar adalah cendawan mikoriza untuk menunjuk cendawannya dan
mikoriza untuk menjelaskan sifat-sifat dan pengaruhnya.
Asosiasi mikoriza memiliki beraneka struktur dan fungsi,
namun salingtindak yang paling sering dijumpai, ditelaah, dan dimanfaatkan
adalah mikoriza arbuskular (MA). Mikoriza arbuskular terbentuk antara sistem
perakaran 80-90% nabatah (vegetation) darat dengan cendawan kelas Zygomisetes
ordo Glomales. Nabatah yang terlibat mulai dari tanaman pertanian,
hortikultura, sampai tanaman kehutanan dan pakan ternak (Smith and Read,
1997). Sekalipun asosiasinya tidak bersifat spesifik untuk satu
jenis atau beberapa jenis tanaman inang namun menariknya MA ditemui hampir pada
semua ekosistem daratan mulai dari
dataran semi gurun, lahan terlantar, gumuk pasir (sand dune), padang rumput, semak-semak, hutan, dan lahan pertanian. Namun demikian MA jarang ditemui
pada hutan yang dikuasai oleh pohon berdaun jarum (conifer).
MA membentuk struktur khusus yang disebut
arbuskula dan vesikula. Arbuskula
merupakan hifa bercabang halus yang dibentuk dari percabangan dikotomi yang
berulang-ulang sehingga menyerupai pohon di dalam sel inang. Vesikula merupakan
struktur cendawan yang berasal dari pembengkakan hifa internal secara terminal
dan interkalar, kebanyakan berbentuk bulat telur, berisi banyak senyawa lemak
sehingga merupakan organ penyimpan cadangan makanan dan pada kondisi tertentu
dapat berperan sebagai spora atau alat untuk mempertahankan kehidupan cendawan.
Simbiosis MA dicirikan oleh lebih pendeknya umur arbuskula dibandingkan dengan
vesikulanya, kolonisasi cepat pada akar-akar yang baru bertumbuh dan berkembang
dan munculnya vesikula hanya pada unit-unit kolonisasi yang paling tua (Smith
dan Read, 1997). Karena vesikula tidak selalu ditemukan sehingga asosiasi
cendawan ditakrifkan hanya berdasarkan keberadaan arbuskulanya. Hifa
cendawannya menyebar dalam akar tanaman dalam bentuk hifa linier ataupun
gulungan hifa (Brundrett, 1996).
Pembentukan
dan perkembangan MA dipengaruhi oleh berbagai faktor, misalnya suhu tanah dan
intensitas cahaya (Smith et al.,
1995; Nagahashi et al., 2000),
kemasaman tanah (Habte, 1999), kadar hara tanah (Ahiabor and Hirata,1994),
senyawa-senyawa kimia pertanian seperti pupuk (Onguene and Habte, 199) dan
pestisida (Sukarno et al., 2000),
jasad renik tanah dan hasil metabolisme tanaman inang (Varma, 1999).
Cendawan mikoriza arbuskular (CMA) adalah semua
warga kelas Zygomisetes yang hanya
memiliki satu ordo yaitu Glomales
(Morton dan Benny, 1990). Ordo ini memiliki dua subordo yaitu Glominae dan
Gigasporinae. Diagram klasifikasinya adalah sebagai berikut :
Ordo : Glomales Morton & Benny
Sub ordo :
Glominae Morton & Benny
Famili : Glomaceae
Pirozynski & Dalphe
Genus : Glomus Tulasne & Tulasne
Genus : Sclerocystis (Berkeley & Broome) Almeida & Schenck
Famili : Acaulosporaceae
Morton & Benny
Genus : Acaulospora (Gerdeman & Trappe) Berch
Genus : Entrophosphora Ames & Schneider
Sub ordo : Gigasporinae Morton & Benny
Famili : Gigasporaceae
Morton & Benny
Genus : Gigaspora (Gerdemann & Trappe) Walker & Sanders
Genus : Scutellospora Walker & Sanders
Usia CMA sesungguhnya jauh lebih
tua daripada peradaban manusia (Pirozynski dan Malloch,
1975; Pirozynski dan Dalpe, 1989). Hifa dan arbuskulanya telah dilaporkan ada
pada fosil yang berasal dari awal jaman Devonian (Remy et al., 1994; Taylor et al.,
1995). Analisis 18s rDNA menunjukkan cendawan anggota ordo Glomales tersebut
berusia antara 350 sampai 450 juta tahun dan adanya simbiosis merupakan
indikator keberhasilan tanaman mengkolonisasi lahan (Simon et al., 1993).
Kolonisasi sistem perakaran
oleh CMA menghasilkan manfaat langsung bagi tanaman inang yaitu meningkatkan
serapan hara khususnya fosfat (Smith et
al., 1995),
meningkatkan ketahanan tanaman terhadap cekaman abiotik misalnya cekaman lengas
(Stahl et al., 1998) dan cekaman
logam berat (Ricken dan Hofner, 1996),
dan cekaman biotik misalnya serangan patogen akar (Newsham et al., 1995; Sylvia dan Chellemi,
2001). Selain itu, CMA dapat memperbaiki struktur tanah (Bearden
dan Petersen, 2000) dan mampu menghasilkan zat
pengatur tumbuh misalnya auksin, sitokinin, dan giberellin. Zat pengatur tumbuh
ini sangat diperlukan untuk proses pembelahan sel, memacu pertumbuhan, serta
mencegah atau memperlambat proses penuaan sehingga memperlama fungsi akar
sebagai penyerap unsur hara dan air. Pengamatan adanya pengaruh kadar lengas
terhadap perkecambahan spora menghasilkan kesimpulan bahwa kolonisasi CMA pada
akar tanaman, yang berarti pula pengaruh menguntungkan CMA terhadap tanaman
inang, dapat berubah sejalan dengan waktu (Auge, 2001).
Meningkatnya
serapan hara akibat kolonisasi CMA disebabkan sedikitnya oleh tiga hal, yaitu
i) CMA mampu mengurangi jarak yang harus ditempuh unsur hara untuk mencapai
permukaan akar tanaman ii) meningkatnya rerata serapan unsur hara dan
konsentrasi pada permukaan penyerapan dan iii) mengubah secara kimia
sifat-sifat unsur hara kimia sehingga memudahkan penyerapan unsur hara tersebut
ke dalam akar tanaman (Sylvia, 1999; Suhardi dan Sumardi, 1999). Akar tanaman
yang bermikoriza akan terlindung dari serangan patogen akar karena karena
secara fisik dilindungi oleh hifa dan secara kimiawi akar tanaman yang
bermikoriza menghasilkan senyawa yang bersifat anti patogen dan dapat
memproduksi hormon dan zat pengatur tumbuh bagi tanaman (Nylund and Wallander, 1992; Hahn et al., 1999). Pada
galibnya dapat disimpulkan bahwa kolonisasi akar tanaman oleh CMA akan
meningkatkan kebugaran tanaman sebagaimana telah ditakrifkan tadi.
III. Strategi Pembuatan Inokulum Bebas Patogen
Permasalahan besar yang dihadapi umat manusia
untuk memanfaatkan CMA, yang keunggulannya telah disebutkan tadi, adalah sifat
CMA yang obligat. Sebagai jasad obligat,
CMA hanya mampu melengkapi daur hidupnya
jika mampu mengkolonisasi sistem perakaran tanaman inang. Rerata hidup CMA
dalam kultur hanya 25 – 30 hari dengan tanpa jaringan tanaman inang. Tahana (state) obligat demikian telah
menyulitkan produksi massal inokulumnya namun sekaligus membangkitkan minat
penelitian yang tiada henti. Yang dimaksud dengan inokulum CMA adalah i)
seluruh bagian tubuh mikoriza termasuk spora, tandan spora, dan hifa, ii) akar
tanaman inang yang terinfeksi CMA, dan iii) media tumbuh yang digunakan dalam
memproduksi inokulum. Satu masalah yang dihadapi dalam pembuatan inokulum CMA
adalah kemungkinan tertularnya inokulum dengan patogen, apalagi CMA sulit
diproduksi secara aksenik. Aksenik bermakna tidak ada “pendatang haram”,
sering juga disebut dengan aseptis atau steril (Williams, 1992), dengan kata lain bebas
patogen. Jadi, kultur cendawan mikoriza aksenik adalah kultur CMA bebas patogen
yang ditumbuhkan secara simbiotis pada akar tanaman inang dalam medium tumbuh
tertentu.
Patogen akan ditemui pada inokulum CMA jika ada
sumber inokulum patogen, sistem simbiosis tersebut tidak sehat atau tidak
bugar, dan tidak ada mekanisme yang mampu menolak atau mengobati akibat
serangan patogen. Ada dua sumber pathogen yang berkemungkinan menulari atau
mengkontaminasi inokulum mikoriza ketika diproduksi, yaitu i) bahan dan
peralatan yang digunakan dan ii) lingkungan produksi. Bahan yang dimaksud
disini diantaranya adalah i) media perbanyakan dan media tanaman inang misalnya
tanah, gambut, bahan mineral misalnya zeolit, dan sebagainya, ii) air, iii) bahan-bahan kimia yang diperlukan untuk
keperluan lain sehubungan dengan produksi inokulum, iv) tanaman inang dan v)
spora mikoriza itu sendiri. Sistem simbiosis tidak bugar manakala kekurangan
nutrisi dan faktor tumbuh lainnya. Mekanisme yang mampu menolak patogen akan
terbentuk manakala mikoriza mampu memproduksi zat-zat anti patogen atau mampu
berkolaborasi dengan komunitas jasad renik lain yang bersifat anti patogen.
Hasil pelacakan ultrastruktural menunjukkan
permukaan spora CMA dihuni oleh jasad serupa bakteri (Bianciotto et al., 1996). Berdasarkan analisis
sidik DNA, bakteri tersebut dapat digolongkan sebagah pseudomad group II atau
genus Burkholderia. Fungsi dan peran bakteri tersebut belum diketahui, namun
demikian ada hal lain yang dapat disimpulkan yaitu asosiasi mikoriza
sesungguhnya melibatkan tiga unsur penting yaitu tanaman, cendawan, dan
bakteri; jadi bukan semata-mata antara tanaman dengan cendawan saja (Bianciotto
et al., 1996, 2000).
Ada tiga strategi yang dapat digunakan untuk mengatasi kemungkinan merebaknya patogen dalam sistem produksi inokulum mikoriza yaitu penghindaran, penyehatan, dan penolakan. Strategi penghindaran merupakan upaya yang dilakukan sedini mungkin untuk menghindarkan sistem produksi inokulum dari kontaminasi patogen. Strategi penyehatan dapat dilakukan dengan penyediaan faktor tumbuh yang cukup, baik untuk cendawan mikoriza maupun tanaman inang. Strategi penolakan dapat dilakukan dengan melibatkan jasad-jasad renik non-patogen yang secara langsung maupun tidak langsung dapat menekan berkembangnya patogen yang ada dalam substrat. Secara ringkas ketiga strategi tersebut disajikan pada Gambar 1.
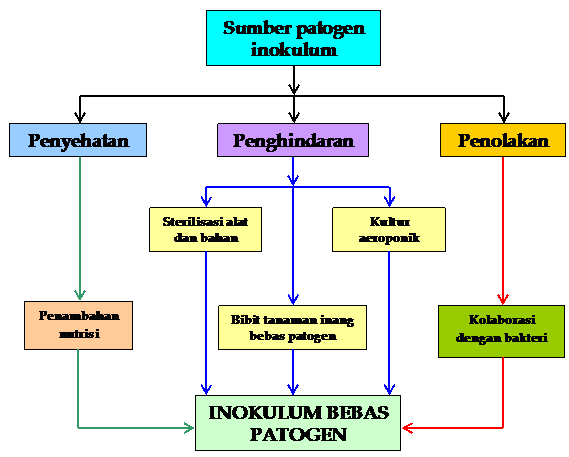
Gambar 1. Model strategi produksi inokulum cendawan
mikoriza bebas patogen
3.1 Strategi penghindaran
Kata kunci dari strategi penghindaran adalah
bekerja sesteril mungkin yang dapat dicapai melalui sterilisasi bahan dan alat,
penempatan sistem produksi inokulum, penggunaan kultur aeroponik, dan
penggunaan bibit tanaman inang yang bebas patogen.
Seluruh
komponen sistem produksi inokulum harus disterilisasi sebelum produksi inokulum
dimulai. Tujuan sterilisasi adalah untuk menghilangkan semua propagul mikoriza
yang tidak dikehendaki, jasad patogen yang ada pada media atau pada spora
mikoriza baik yang di dalam maupun yang ada di permukaannya, dan biji-biji
gulma, namun masih mempertahankan komunitas jasad renik non-patogen. Sterilisasi
dapat dilakukan dengan berbagai cara misalnya dengan menggunakan bahan kimia,
padat ataupun cair, yang komposisi dan waktu sterilisasinya dapat diatur,
sterilisasi ultrasonik, maupun radiasi sinar ultraviolet.
Bahan
kimia yang sering digunakan diantaranya adalah campuran metil bromida dan
kloropikrin (Sylvia, 1994),
tetrahydro-3,5,-dimethyl-2H-1,3,5-thiadiazine-2-thione atau Basamid (BASF Corporation, 1998) atau
biosida tanah lainnya. Kedua bahan kimia tersebut diberikan melalui fumigasi
media tumbuh. Setelah media diperlakukan dengan biosida, kemudian dibiarkan
selama beberapa hari untuk memberikan kesempatan bahan kimia berdifusi ke
seluruh volume media. Kelemahan sterilisasi media dengan metil bromida ataupun
khloropikrin adalah tidak mampu memberantas cendawan Fusarium dan Phytophthora,
selain itu media yang difumigasi seringkali dikolonisasi kembali oleh berbagai
jenis cendawan tergantung kepada faktor-faktor edafik dan lingkungannya (Sylvia
dan Chellemi, 2001).
Fungisida
memang dapat digunakan untuk memberantas propagul cendawan yang ada dalam
tanah. Namun demikian, pengaruhnya terhadap tanaman inang dan cendawan mikoriza
seringkali tidak menentu tergantung kepada jenis fungisida, komposisi kimia,
takaran yang digunakan, dan jenis tanaman inangnya (von Alten et al., 1993). Aliette (fosetyl-Al)
berpengaruh negatif terhadap tanaman bawang merah akan tetapi tidak berpengaruh
terhadap cendawan mikoriza, sebaliknya Benlate dan Ridomil berpengaruh negatif
terhadap tanaman inang dan cendawan mikorizanya (Sukarno et al., 2000). Fungisida yang ampuh membasmi patogen bukanlah
segala-galanya, diperlukan kehati-hatian
jika menggunakan fungisida dalam sistem produksi inokulum mikoriza.
Sterilisasi
alat dapat dilakukan dengan membasuh peralatan dengan alkohol atau dengan
autoklaf. Namun demikian, tidak dianjurkan melakukan sterilisasi media dengan
autoklaf karena dapat mendorong pembentukan toksin, senyawa-senyawa organik,
dan meningkatkan kelarutan unsur mikro yang tidak menguntungkan mikoriza (Wolf et al., 1989).
Spora cendawan mikoriza dilaporkan berasosiasi
dengan berbagai jenis bakteri dan
aktinomisetes (Secilia dan Bagyaraj, 1987; Ames et al., 1989) serta cendawan (Sylvia dan Schenck, 1983) baik di
dalam ataupun di permukaan sporanya. Jasad-jasad renik tersebut pada umumnya
merupakan jasad penghuni rizosfir dan dengan demikian berkemungkinan merupakan
jasad yang bersifat patogen. Jasad-jasad yang patogen perlu dinonaktifkan
sebelum spora mikoriza diperbanyak dalam kultur. Sterilisasi spora cendawan
mikoriza dapat dilakukan dengan deterjen cair misalnya Tween 20 dan
Na-hipoklorite 0,02% yang biasa digunakan untuk mencuci pakaian, atau zat
antibiotika misalnya Khloramin T 2% dan Streptomisin sulfat 0,02% (Jartsfer dan
Sylvia, 1995). Spora yang akan disterilkan ditaruh di permukaan kertas saring
yang terletak pada corong gelas. Larutan
pendisinfeksi dialirkan melalui spora dan biarkan selama 15 menit untuk
memberikan kesempatan spora bereaksi dengan larutan tersebut. Larutan disinfektan
kemudian dicuci dengan air steril sebanyak lima kali.
Yang perlu diperhatikan dalam mensterilkan spora
cendawan mikoriza adalah kombinasi antara bahan kimia dan lama inkubasinya. Perendaman
spora cendawan mikoriza selama 120 menit dalam larutan kloramin-T sudah mampu
menekan kontaminasi sampai ≤ 10% (Walley dan Germida, 1996). Waktu
perendaman dapat lebih singkat jika menggunakan campuran berbagai jenis bahan
kimia. Budi et al (1999) melaporkan
inkubasi selama 10 detik dalam etanol 96%, diikuti 10 menit dalam larutan
campuran kloramin T 2% + streptomisin 0,02% + gentamisin 0,01% + Tween 20, dan
kemudian 6 menit dalam kalsium hipoklorit 6% dapat menekan secara drastis
kontaminasi bakteri dan cendawan dari sporokarpa Glomus mosseae dengan tanpa mengubah laju perkecambahan
sporanya.
Metoda sterilisasi spora cendawan memiliki
beberapa kelemahan diantaranya adalah harus ada kesetimbangan antara
konsentrasi bahan dan lama sterilisasi. Bahan yang terlalu tinggi
konsentrasinya akan membunuh patogen sekaligus cendawan mikorizanya (Budi et al., 1999), sterilisasi yang singkat
mungkin tidak akan berhasil meniadakan bakteri yang bermukim jauh di dalam
dinding spora ataupun dinding hifa (Walley dan Germida, 1996). Jika demikian halnya maka keberhasilan
sterilisasi permukaan spora masih perlu dipertanyakan dan hasilnya harus diuji
kembali dengan media yang sesuai. Kekeliruan memilih media uji akan menyebabkan
kekeliruan dalam pengambilan kesimpulan keberhasilan sterilisasi permukaan
spora CMA. Untuk Glomus mosseae, Budi
et al. (1999) menemukan media ekstrak
malt sesuai untuk pengujian pasca sterilisasi permukaan, dengan media ini
tandan spora CMA yang terinfeksi patogen akan dengan mudah dihilangkan. Persoalannya
adalah media tersebut boleh jadi tidak sesuai jika digunakan untuk spora CMA
yang lain. Sterilisasi permukaan spora CMA untuk menumpas bakteri patogen
dengan demikian akan menjadi tidak ekonomis lagi jika digunakan secara rutin. Para
peneliti masih harus bekerja lebih keras lagi untuk mendapatkan metoda
dekontaminasi yang murah namun efektif hasilnya.
Udara pada ruangan produksi inokulum mikoriza
harus bebas dari spora atau bagian-bagian lain dari mahluk hidup atau benda
yang berkemungkinan mencemari inokulum mikoriza. Untuk itu akan sangat baik
jika produksi inokulum di lakukan dalam ruangan yang sudah disterilisasi
terlebih dulu, namun demikian aliran udara dan pencahayaan harus tetap dalam
keadaan optimal. Ruangan harus diupayakan tidak berdekatan dengan sumber
patogen, misal bersebelahan dengan ruang yang digunakan untuk meneliti jasad
renik (cendawan, bakteri, aktinomisetes ataupun virus), atau gudang penyimpanan
bahan tanaman atau makanan. Jika tidak tersedia ruangan berupa kamar, produksi
inokulum dapat dilakukan di luar gedung, namun harus menggunakan tempat yang
beratap dan berdinding (tidak harus tembok). Namun tempat demikian harus
dijauhkan juga dari sumber-sumber pencemar. Jika menggunakan media pot
sebaiknya pot ditaruh pada ketinggian tertentu dari lantai, ini dilakukan untuk
menjaga agar tidak terkontaminasi patogen yang terbawa oleh percikan air yang
jatuh bebas ke permukaan lantai.
Mengingat media tanah, gambut, dan yang lainnya
kerap dituding sebagai penyebab hadirnya patogen maka penggunaan kultur cawan
petri atau kultur tabung reaksi menggunakan bahan non-tanah (misalnya zeolit)
dan kultur aeroponik dapat dijadikan sebagai salah satu alternatif. Kultur tabung reaksi dilaporkan mampu
menghasilkan hifa lebih banyak dibandingkan dengan kultur cawan petri (Tabel
1).
Tabel 1. Pembentukan hifa
CMA pada minggu ke 4 sampai 20 setelah peng-kulturan (Bertham, 2003)
|
CMA |
Kultur cawan petri |
Kultur tabung reaksi |
||||||||
|
Minggu ke |
||||||||||
|
4 |
8 |
12 |
16 |
20 |
4 |
8 |
12 |
16 |
20 |
|
|
Glomus manihotis |
5 |
7 |
10 |
7 |
7 |
0 |
7 |
18 |
12 |
12 |
Glomus etunicatum
|
2 |
9 |
7 |
6 |
7 |
0 |
5 |
9 |
12 |
17 |
Glomus aggregatum
|
0 |
0 |
5 |
11 |
15 |
0 |
2 |
11 |
16 |
19 |
Gigaspora margarita
|
29 |
7 |
6 |
0 |
0 |
25 |
19 |
0 |
0 |
0 |
Acaulospora tuberculata
|
4 |
8 |
4 |
8 |
8 |
3 |
7 |
13 |
6 |
7 |
Bahan non-tanah
yang dapat digunakan dalam kultur CMA diantaranya adalah zeolit, inolite,
pasir, pecahan batu dan lain sebagainya. Kesemuanya, sudah barang tentu, tidak terhindar dari keharusan sterilisasi
untuk menjamin agar tidak terkontaminasi dengan patogen. Kombinasi antara bahan, spesies CMA, dan
tanaman inang akan menentukan keberhasil pembuatan inokulum yang banyak dengan
harga murah (Tabel 2).
Tabel 2. Pengaruh substrat dan tanaman inang terhadap sporulasi empat
spesies indigenous Indonesia (Setiadi, 2002)
|
Spesies CMA |
Substrat |
Σ spora per gram inokulum |
|||||
|
Pueraria
javanica |
Sorghum
bicolor |
Paspalum
notatum |
|||||
|
A.
delicata |
Inolit |
216 |
a |
70 |
def |
166 |
b |
|
|
Zeolit |
107 |
c |
100 |
cd |
105 |
c |
|
|
Pasir |
61 |
ef |
91 |
cde |
55 |
f |
|
G.
manihotis |
Inolit |
42 |
b |
35 |
b |
38 |
b |
|
|
Zeolit |
18 |
b |
41 |
b |
22 |
b |
|
|
Pasir |
33 |
b |
81 |
a |
24 |
c |
|
A.
tuberculata |
Inolit |
49 |
bc |
33 |
cd |
25 |
cd |
|
|
Zeolit |
61 |
ab |
41 |
bc |
45 |
bc |
|
|
Pasir |
83 |
a |
32 |
cd |
12 |
d |
|
G.
mosseae |
Inolit |
62 |
a |
18 |
b |
18 |
b |
|
|
Zeolit |
4 |
b |
10 |
b |
4 |
b |
|
|
Pasir |
21 |
b |
30 |
b |
15 |
b |
Keterangan : Rerata diikuti
huruf sama pada kolom dan baris yang sama berbeda tidak nyata pada p < 0,05
Ditinjau dari aspek teknologinya, kultur aeroponik
dilaksanakan dengan pengkabutan larutan hara pada sistem perakaran inang
terinfeksi mikoriza pada sebuah ruang tertutup. Tanaman inangnya digantungkan
di udara dengan tanpa menggunakan substrat atau media tumbuh apapun. Kultur
aeronoponik pada awalnya digunakan untuk mengaji salingtindak legume-rhizobia
oleh Zobel et al. (1976) dan kemudian
pada cendawan mikoriza arbuskula oleh Sylvia dan Hubbell (1986). Kultur
aeroponik telah terbukti sebagai satu sistem yang efisien untuk menumbuhkan
inokulum CMA dengan tanpa adanya media. Kelebihan kultur aeroponik diantaranya
adalah i) terbebas dari media yang berkemungkinan membawa patogen, ii)
kondisinya lebih oksidatif dibandingkan dengan metoda hidroponik, iii)
pengontrolan kondisi lingkungan dan pengelolaan inokulumnya lebih mudah, iv)
terbebas dari kewajiban melakukan sterilisasi substrat, v) memungkinkan kajian
salingtindak hara dan salingtindak antar jasad renik yang lebih kompleks, dan vi)
sanitasi lebih terjaga sehingga terbebas dari jasad renik patogen.
Bahan tanaman juga berpotensi sebagai pembawa
patogen. Upaya yang dapat dilakukan adalah dengan disinfeksi benih, menggunakan
bibit tanaman asal perbanyakan kultur jaringan ataupun menggunakan kultur organ
akar. Disinfeksi benih merupakan cara yang paling murah meriah dan mudah
pelaksanaannya. Perbanyakan bibit tanaman dengan kultur jaringan memang dapat
menghasilkan bibit tanaman yang bebas patogen. Namun demikian dewasa ini masih
dipandang sebagai metoda yang prosedurnya cukup rumit dan memerlukan
bahan-bahan yang tidak murah serta memerlukan ketrampilan khusus. Dengan kultur
organ akar memang akan didapatkan inokulum mikoriza yang bebas patogen (Tiwari
dan Adholeya, 2002) namun metoda ini juga dirasakan tidak ekonomis mengingat
keharusannya menggunakan teknologi aras tinggi dan tenaga kerja yang sangat
terlatih, serta tidak dapat digunakan untuk mengaji sporulasi cendawan
sebagaimana halnya pada metoda pot tradisional (Wood, 1991; Chabot et al.
1992, Sylvia dan Jarstfer, 1994).
Upaya lain yang dapat ditempuh adalah dengan
memilih spesies-spesies tanaman inang yang secara alami mampu mengembangkan
mekanisme pertahanan diri terhadap patogen. Mekanisme yang dikembangkan tanaman diantaranya adalah
i) meningkatkan kadar lignin atau suberin dinding sel-selnya, ii) pelepasan
metabolit-metabolit sekunder anti patogen seperti asam hidroksamat siklis dan
saponin, atau iii) pelepasan
metabolit-metabolit yang disukai jasad renik anti patogen yang hidup di
rizosfir (Osbourn, 2001). Permasalahan yang dihadapi adalah masih terbatasnya
pengetahuan tentang pengaruh metabolit demikian terhadap CMA. Selain itu
tanaman yang mampu membentuk metabolit demikian belum tentu merupakan tanaman
inang yang sesuai untuk produksi massal inokulum CMA.
3.2 Strategi penyehatan
Kata kunci dari strategi ini adalah kebugaran
tubuh mahluk hidup berkorelasi dengan serangan patogen. Tubuh yang bugar akan
lebih tahan terhadap serangan patogen daripada yang tidak. Kebugaran dapat
dicapai jika mahluk hidup memperoleh nutrisi, baik dalam bentuk organik maupun
anorganik, yang cukup namun tidak berlebihan.
Dalam pustaka telah disebutkan adanya keterkaitan
antara kelebihan dan kekahatan hara dengan merebaknya patogen pada rizosfir dan
terserangnya tanaman inang. Sebagai contoh unsur nitrogen dalam jumlah berlebih
akan mendorong berkembangnya Fusarium
sebaliknya kekahatan fosfor akan menyebabkan berkembangnya Phytium (Bruehl, 1987). Akan tetapi kadar fosfor yang semakin
meningkat dilaporkan dapat menekan pembentukan dan perkembangan cendawan
mikoriza. Meningkatnya kadar fosfor, baik sebagai akibat penambahan hara maupun
karena aktivitas mikoriza juga dilaporkan tidak selalu berkorelasi dengan
berkurangnya gejala serangan patogen pada berbagai sistem tanaman-patogen
(Newsham et al., 1995). Jawaban dari
permasalahan demikian adalah diperlukan kehati-hatian dalam menyusun komposisi
hara yang diperlukan dalam produksi inokulum mikoriza. Kekeliruan penetapan
jenis dan konsentrasi hara media akan berakibat pemborosan belaka jika ternyata
tidak berhasil menyehatkan tanaman dan inokulum mikorizanya.
Bahan organik, baik yang alami (Henis, 1986)
maupun polimer-polimernya (Hadar, 1986), dapat menekan perkembangan
patogen-patogen tanah seperti Fusarium,
Phytium, Rhizoctonia dan sebagainya. Tanah yang berkadar bahan organik
tinggi pada umumnya juga lebih supressive
terhadap patogen (Hadar, 1986). Penggunaan kompos dilaporkan juga dapat menekan
perkembangan patogen (Hoitink dan Kuter, 1986). Komponen utama bahan organik
adalah asam humat dan asam fulvat. Potensi asam humat untuk perbaikan
sifat-sifat tanah dan peningkatan produktivitas tanaman telah diulas oleh
Goenadi (1999). Asam fulvat memang pernah dilaporkan mampu meningkatkan
pertumbuhan vegetatif cendawan ektomikoriza Pisolithus
tinctorius (Tan dan Napanornbodi, 1979). Sayang sekali peran asam humat dan
asam fulvat dalam produksi inokulum mikoriza bebas patogen belum diteliti. Namun demikian, mengingat adanya peran bahan
organik dalam menekan perkembangan patogen maka bukan tidak mungkin asam humat
dan asam fulvat juga berpengaruh negatif terhadap patogen tertentu. Jika hal
tersebut dapat dicapai berarti diperoleh suatu keuntungan berupa hilangnya
kewajiban mensterilkan media.
Kelemahan strategi ini adalah tidak menentunya
sifat dan pengaruh bahan organik terhadap media, tanaman, dan cendawan
mikoriza. Bahan organik yang sama akan menghasilkan pengaruh yang berbeda jika
cendawan tanaman inang, cendawan mikoriza dan patogennya berbeda. Bahan organik
yang sama yang diberikan kepada tanaman yang sama dapat bereaksi berbeda jika
diberikan pada medium yang sifatnya berbeda. Pengaruh bahan organik ditentukan
oleh takaran, cara pemberian dan saat pemberiannya. Pengabaian terhadap hal
tersebut akan menyebabkan munculnya
pengaruh yang tidak diduga.
3.3 Strategi penolakan
Kata kunci dari strategi penolakan adalah adanya
sistem dakhil (internal) asosiasi
mikoriza yang dapat secara langsung ataupun tidak langsung menekan
berkembangnya patogen yang ada dalam substrat.
Para peneliti telah menemukan bahwa cendawan
mikoriza dapat berasosiasi dengan berbagai jenis jasad renik pada permukaan dan
di dalam sporanya serta jasad renik di rizosfir inang. Bakteri yang umum
ditemukan berasosiasi dengan cendawan mikoriza adalah Bacillus, Enterbobacter, Flavobacterium, Micrococcus, Pseudomonas, Streptomyces (Varese et al., 1996), dan rhizobia (Bianciotto et al., 1996). Bakteri-bakteri demikian
mampu membantu cendawan mikoriza melawan patogen melalui berbagai mekanisme. Bakteri
gram positif umumnya tidak mempengaruhi pertumbuhan mikoriza, sebaliknya dengan
bakteri gram negatif. Mekanisme penekanan patogen yang umum terjadi adalah
melalui i) pembentukan metabolit anti patogen, misalnya
2,4-diasetilflorogusinol (DAPG) (Barea et
al., 1998), pioluteorin, pirolinitrin, dan fenazine (Paulitz and Linderman,
1989), ii) pembentukan siderofor yaitu senyawa yang mampu mengkhelasi ion Fe2+
dari medium sehingga tidak dapat dimanfaatkan oleh jasad patogen (Carson et al., 1992), iii) pembugaran inang dan
cendawan mikoriza melalui penyediaan hara nitrogen bakteri penyemat nitrogen
asosiatif (Secilia dan Bagyaraj, 1987) dan pelarutan fosfor oleh
bakteri-bakteri tertentu (Chabot et al.,
1996), iv) pembentukan senyawa-senyawa organik yang bersifat asam atau
antibiosis (Schelkle dan Peterson, 1996), dan v) pembentukan fitohormon
(Williams dan Signer, 1990).
Kelemahan strategi ini adalah belum semua bakteri
yang hidup pada permukaan spora mikoriza berhasil dikulturkan, perilaku dan
sifat asosiasinya seringkali tidak menentu dan ditentukan oleh banyak faktor
yang tidak jarang saling meniadakan satu dengan lainnya, tanggap inang dan
cendawan mikoriza terhadap jasad renik lain juga berbeda-beda, dan penelitian
mengenai penggunaan bakteri-bakteri demikian pada umumnya masih pada tingkat
laboratorium. CMA yang tergolong pengkolonisasi cepat, misalnya Glomus intraradices, dilaporkan
dapat menekan populasi bakteri rizosfir sedangkan hal sebaliknya terjadi pada
CMA yang tergolong pengkolonisasi lambat, misalnya G. etunicatum (pengkolonisasi lambat). Informasi lain menyebutkan
beberapa strain bakteri dapat menghambat perkecambahan G. etunicatum sekalipun
pengaruh itu akan hilang setelah tujuh hari (Paulitz dan Linderman, 1989). Sebaliknya,
Pseudomonas F113 dilaporkan tidak
menimbulkan pengaruh apapun terhadap laju perkecambahan G. mosseae bahkan dapat merangsang perkembangan hifanya (Vidal et al., 1996).
Laporan-laporan ada dan tidak adanya pengaruh
bakteri terhadap kehidupan patogen dan CMA
tersebut di atas hendaknya dicermati dengan hati-hati. Keberhasilan atau kegagalan pada kondisi
aksenik berskala laboratorium belum tentu dicapai pada skala lapangan yang
memiliki kondisi jauh lebih rumit. Yang tidak kalah peliknya adalah menentukan
siapa yang menjadi “aktor utama” dan siapa pula yang menjadi “aktor pendukung”.
Benarkah bakteri membantu CMA atau justru sebaliknya CMA yang membantu bakteri
?. Jika bakteri yang membantu CMA, bakteri yang manakah yang membantu – yang
ada di permukaan akar atau yang dekat-dekat dengan permukaan akar atau yang
menempel di permukaan hifa dan spora CMA ?. Masalah lain yang dihadapi adalah
seringkali bakteri rizosfir sulit dicampur dengan CMA dalam satu kultur karena
bakteri menghendaki media yang berbeda. Masih ada segudang pertanyaan lain yang
harus dijawab sehubungan dengan itu.
Apapun pertanyaannya, hendaknya umat manusia tidak
surut minatnya dalam mengembangkan strategi-strategi produksi inokulum CMA
bebas patogen. Kesulitan-kesulitan demikian hendaknya dijadikan sebagai
tantangan yang dihadapi dan harus segera dicarikan jawabannya.
IV. Kesimpulan
Dari uraian di atas ada beberapa hal yang dapat
disimpulkan, yaitu :
![]() Mikoriza
merupakan asosiasi yang bersifat simbiotik, netral, ataupun antagonis antara
tanaman, cendawan dan bakteri.
Mikoriza
merupakan asosiasi yang bersifat simbiotik, netral, ataupun antagonis antara
tanaman, cendawan dan bakteri.
![]() Belum
ada strategi produksi inokulum bebas patogen yang benar-benar memuaskan, setiap
strategi mempunyai kelebihan dan kelemahannya masing-masing serta memiliki
resiko tersendiri juga. Untuk menjamin diperolehnya inokulum cendawan mikoriza
yang bebas patogen maka keseluruhan strategi harus dipandang sebagai satu
kesatuan yang utuh. Tidak ada strategi yang dapat berdiri sendiri tanpa
dilengkapi dengan strategi yang lain.
Belum
ada strategi produksi inokulum bebas patogen yang benar-benar memuaskan, setiap
strategi mempunyai kelebihan dan kelemahannya masing-masing serta memiliki
resiko tersendiri juga. Untuk menjamin diperolehnya inokulum cendawan mikoriza
yang bebas patogen maka keseluruhan strategi harus dipandang sebagai satu
kesatuan yang utuh. Tidak ada strategi yang dapat berdiri sendiri tanpa
dilengkapi dengan strategi yang lain.
![]() Para
peneliti masih harus bekerja keras lagi untuk memperoleh metoda produksi
inokulum yang benar-benar dijamin bebas patogen yang biayanya murah.
Para
peneliti masih harus bekerja keras lagi untuk memperoleh metoda produksi
inokulum yang benar-benar dijamin bebas patogen yang biayanya murah.
Daftar Pustaka
Ahiabor, B.D. and H. Hirata. 1994. Characteristic
responses of three tropical legumes to the inoculation of two species VAM in
Andosol soils with different fertilities. Mycorrhiza
5: 63-70.
Augé,
R.M. 2001. Water relations, drought and
vesicular-arbuscular mycorrhizal symbiosis. Mycorrhiza 11: 3–42
Barea, J.M., G. Andrade, V. Bianciotto, D. Dowling, S.
Lohrke, P. Bonfante, F. O’Gara, and C. Azcon-Aguilar. 1998. Impact on
arbuscular mycorrhiza formation of Psedomonas
strains used as inoculants for biocontrol of soil-borne fungal plant pathogens.
Appl. Environ. Microbiol. 64(6):
2304-2307
BASF Corporation, 1998. Basamid – Granular Soil Fumigant.
Bearden, B.N. and L. Petersen. 2000. Influence of
arbuscular mycorrhizal fungi on soil structure agregate stability of a
Vertisol. Plant and Soil 218:
173-183.
Bertham, Y. 2003. Tehnik pemurnian biakan monoxenic CMA dengan metode cawan petri dan
tabung reaksi. Laporan Penelitian Mandiri, Sekolah Pasca Sarjana, IPB.
Bianciotto V., C. Bandi,
D. Minerdi, M. Sironi, H. Volker-Tichy, and P. Bonfante. 1996. An obligately
endosymbiotic mycorrhizal fungus itself harbours obligately intracellular
bacteria. Applied and Environmental
Microbiology 62: 3005-3010.
Bianciotto V., E. Lumini,
L. Lanfranco, O. Minerdi, P. Bonfante P, and S. Perotto. 2000. Detection and
identification of bacterial endosymbionts in arbusculas mycorrhizal fungi
belonging to the family Gigasporaceae. Applied
and Environmental Microbiology 46: 4503-4509.
Bianciotto, V., D. Minerdi, S. Perotto, and P.
Bonfante. 1996. Cellular interactions between arbuscular mycorrhizal fungi and
rhizosphere bacteria. Protoplasma
193: 123-131
Brundrett, M., N. Bougher, B. Dell, T. Grove, and N.
Malajczuk. 1996. Working with Mycorrhizas
in Foretsry and Agriculture. ACIAR.
Budi, S.W., Blal, B., and S. Gianinazzi. 1999.
Surface-sterilization of Glomus mosseae
sporocarps for studying endomycorrhization in vitro. Mycorrhiza 9: 65-68
Carson, K.C., S. Holliday, A.R. Glenn, and M.J.
Dilworth. 1992. Siderophore and organic acid production in root nodule
bacteria. Arch. Microbiol. 157:
264-271
Chabot, R., H. Antoun, and M.P. Cescas. 1996. Growth
promotion of maize and lettuce by phosphate-solubilizing Rhizobium leguminosarum biovar. phaseoli.
Plant Soil 184: 311-321
Chabot, S., G. Becard, and Y. Piche. 1992. Life cycle
of Glomus intraradix in root organ
culture. Mycologia 84: 315-321
Goenadi, D.H. 1999. The potential use of humic acids. Jurnal Ilmu Tanah dan Lingkungan 2(2): 23-31
Habte, M. 1999. Soil acidity as a constraint to the
aplication of arbuscular mycorrhizal technology. Pp. 557-614 in A. Varma and B. Hock. Mycorrhiza: Structure Function, Molecular
Biology and Biotechnology. 1st ed.Springer-Verlag,
Hadar, Y. 1986. The role of organic matter in the
introduction of biofertilizers and biocontrol agents to soils. Pages 169-179 in Y. Chen and Y. Avnimelech (eds). The Role of Organic Matter in Modern
Agriculture. Martinus Nijhoff Publ.,
Hahn, A., C. Gobel and B. Hock. 1999. Immunochemical
properties of mycorrhizas. Pp.: 177-201 in
A.Varma and B. Hock (eds). Mycorrhiza:
Structure Function, Molecular Biology and Biotechnology. 1st ed.
Henis, Y. 1986. Soil microorganisms, soil organic
matter, and soil fertility. Pages 159-168 in
Y. Chen and Y. Avnimelech (eds). The Role
of Organic Matter in Modern Agriculture. Martinus Nijhoff Publ.,
Hepper, C.M. 1984. Isolation and culture of VA
mycorrhiza (VAM) fungi. Pages 95-112 in
C.L. Powell and D.J. Bagyaraj (eds) V.A.
Mycorrhiza. CRC Press,
Hoitink, H.A.J. and G.A. Kuter. 1986. Effects of
composts in growth media on soil borne pathogens. Pages 289-306 in Y. Chen and Y. Avnimelech (eds). The Role of Organic Matter in Modern
Agriculture. Martinus Nijhoff Publ.,
Jarstfer, A.G and D.M. Sylvia, 1995. Aeroponic culture
of VAM fungi. Pages 427-441 in A. Varma and B. Hock, eds. Mycorrhiza. : Structure Function, Molecular Biology and Biotechnology. 1st
ed.
Jartsfer, A.G. and D.M. Sylvia. 1995. Inoculum
production and inoculation strategies for vesicular-arbuscular mycorrhizal
fungi. Pages 349-377 in Metting, B.
ed. Soil Microbial Ecology : Applications
in Agriculture and Environmental Management. Marcel
Morton J.B. and G.L.
Benny. 1990. Revised classification of arbuscular mycorrhizal fungi
(Zygomycetes): a new order, Glomales, 2 new suborders, Glomineae and
Gigasporineae, and 2 new families, Acaulosporaceae and Gigasporaceae with an
recommendation of Glomaceae. Mycotaxon
37: 471-491.
Nagahashi, G., D. Douds, Jr. and M. Buee. 2000.
Light-induced hyphal branching of germinated AM fungal spores. Plant and Soil 219: 71-79.
Newsham, K.K., A.H.
Fitter, and A.R. Watterson. 1995. Arbuscular mycorrhiza protect an annual grass
from root pathogenic fungi in the field. Journal
of Ecology 83: 991-1000.
Nylund, J.E. and H. Wallander. 1992. Auxin production
mycorrhizal virulence. Pp. 394-395. in
D.J. Read, D.H. Lewis, A.H. Fitter, and I.J. Alexander (eds) Mycorrhizas
in Ecosystems. CAB International,
Onguene, N.A. and M. Habte. 1995. Nitrogen and
phosphorus requirements for raising mycorrhizal seedlings of Leucaena leucocephala in containers. Mycorrhizae 5: 347-356.
Osbourn, A.E. 2001. Plant mechanisms that give defence
against soilborne diseases. Australasian
Plant Pathology. 30: 99-102
Paulitz, T.C. and R.G. Linderman. 1989. Interactions
between fluorescent pseudomonads and VA mycorrhizal fungi.New Phytol. 113: 37-45
Pirozynski KA, Dalpe Y.
1989. Geological history of the Glomaceae with particular reference to
mycorrhizal symbiosis. Symbiosis 7:
1-36.
Pirozynski KA, Malloch
DW. 1975. The origin of land plants: a matter of mycotrophism. Biosystems 6: 153-164.
Read, D.J. 1999. Mycorrhiza-the state of the art. p.
43-49 in A. Varma and B. Hock (eds) Mycorrhiza: Structure Function, Molecular
Biology and Biotechnology. 1st ed.
Remy W, T.N.,
Ricken, B. and W. Hofner.
1996. Effect of arbuscular mycorrhizal fungi (AMF) on heavy-metal tolerance of
alfafa Medicago sativa L. and oat Avena sativa L. on a sewage sludge
treated soil. Zeitschrift fuer
Planzenernahrung und Bokenkunde 159: 189-194.
Schelkle, M. and R.L. Peterson. 1996. Suppression of
common rot pathogens by helper bacteria and ectomycorrhizal fungi in vitro. Mycorrhiza 6: 483-485
Secilia, J. and D.J. Bagyaraj. 1987. Bacteria and
actinomycetes associated with pot culture of vesicular-arbuscular mycorrhizae.
Setiadi, Y. 2002. Mycorrhizal inoculum production
technique for land rehabilitation. Trop.
For. Manage. J. VIII(1) : 51-64
Simon, L., J. Bousquet,
R.C. Levesque, M. Lalonde. 1993. Origin and diversification of endomycorrhizal
fungi and coincidence with vascular plants. Nature
363: 67-69.
Smith, S. E, J.B. Baon, and A.M. Alston.
1995. P efficiency of barley infected by Glomus
intradices: Influences of soil
temperature and light intensity. Biotrop
Special Publication No.56. SEAMEO BIOTROP, Bogor,. Indonesia.
Smith, S.E. and D.J.
Read. 1997. Mycorrhizal Symbiosis.
Stahl, P.D., G.E. Schuman, S.M. Frost, and S.E.
Williams. 1998. Arbuscular mycorrhizae and water stress tolerance of Wyoming
Big Sagebrush seedlings. Soil Sci. Soc.
Am. J. 62: 1309-1313.
Suhardi dan Sumardi. 1999. Peranan mikoriza dalam
pengelolaan hutan yang berkelanjutan. Makalah pada Simposium dan Seminar Ilmiah
Perhimpunan Fitologi
Sukarno, N., S.E. Smith, and E.S. Scott. 2000. The
effect of fungicides on vesicular-arbuskular mycorrhizal symbiosis. Pages 68-83
in Supriyanto, ed. Report on Training Course on Biotechnology
of Mycorrhizae. SEAMEO-BIOTROP, Bogor.
Sylvia, D.M. 1994.
Vesicular-arbuscular mycorrhizal fungi. Pages
351-378 in Methods of Soil Analysis, Part 2. Microbiological and Biochemical
Properties. SSSA Book Series No. 5. SSSA Inc.,
Sylvia, D.M. 1999. Fundamentals and aplications of
arbuscular mycorrhizae: A “biofertilizer” perpective in J.Q. Siqueira, F.M.S. Moreira, A.S. Lopez, L.R.G. Guilherme, F.
Faquin, A.E.F. Neto, and J.G. Carvalho
(eds) Soil fertility, Soil Biology and
Plant Nutrition Interrelationships. Sociedade Brasiliera de
Ciencia do Solo.Universidade Federal de Lavras. Departemento de Ciencia do
Solo, Brasil.
Sylvia, D.M. and
A.G. Jarstfer. 1994. Production of
inoculum and inoculation with arbuscular mycorrhizal fungi. Pages 231-238 in A.D. Robson, L.K. Abbot, and N.
Malajczuk (eds). Management of
Mycorrhizas in Agriculture, Horticulture and Forestry. Kluwer Academic
Publisher,
Sylvia, D.M. and D.H. Hubbell. 1986. Growth and
sporulation of vesicular-arbuscular mycorrhizal fungi in aeroponic and membrane
systems. Symbiosis 1: 259-267
Sylvia, D.M. and D.O. Chellemi. 2001. Interactions
among root-inhabiting fungi and their implications for biological control of
root pathogens. Adv. Agron 73: 1-33.
Sylvia, D.M. and N.C. Schenck. 1983. Germination of
clamydospores of three Glomus species
as affected by soil matric potential and fungal contamination. Mycologia 75: 30-35
Tan, K.H. and V. Nopanornbodi. 1979. Fulvic acid and
the growth of the ectomycorrhiza fungus Pisolithus
tinctorius. Soil Biol. Biochem.
11: 651-653
Tiwari,
P. and A. Adholeya. 2002. In vitro co-culture of two AMF isolates Gigaspora margarita and Glomus intraradices on Ri T-DNA
transformed roots. FEMS Microbiology
Letters 206 : 39-43
Varma, A. 1999. Fuction and application of AMF in arid
and semi-arid soils. Pp. 521-556. In A.
Varma and B. Hock (eds) Mycorrhiza:
Structure Fuction, Molecular Biology and Biotechnology. 1st ed.
Springer-Verlag, Berlin.
Vidal, M.T., G. Andrade,
C. Azcón-Aguilar and J.M. Barea. 1996.
Comparative effect of Pseduomonas,
strain F113 [biocontrol agent (antifungal)] and its isogenic mutant, strain
F113G22 (impaired biocontrol ability) on spore germination and mycelial growth
of Glomus mosseae under monoxenic
conditions. Pages 673-676 in C. Azcón-Aguilar and J.M. Barea (eds). Mycorrhizas in Integrated Systems From Genes
to Plant Development. EC-DG XII Science, Research and Development,
Von Alten, H., A. Lindemann, and F. Schönbeck. 1993.
Stimulation of vesicular-arbuscular mycorrhiza by fungicides or rhizosphere
bacteri. Mycorrhiza 2: 167-173
Walley, F.L. and J.L. Germida. 1996. Failure to
decontaminate Glomus clarum NT4
spores is due to spore wall-associated bacteria. Mycorrhiza 6: 43-49
Williams, M.N.V. and E.R. Singer. 1990. Metabolism of
typtophan and tryptophan analogs by Rhizobium
meliloti. Plant Physiol. 92:
1009-1013
Williams, P.G. 1992. Axenic culture of arbuscular
mycorrhizal fungi. Methods in Microbiol.
24: 203-220.
Wood, T. 1991. VA mycorrhizal fungi: challenges for
commercialization. Pp. 823-847 in
D.K. Arora, R.P. Elander, and K.G. Mukerji (eds). Handbook of Applied Ecology, Fungal and Biotechnology. Vol 4.
Marcel
Zobel, R.W., P. del Tredici, and J.G. Torrey. 1976.
Methods for growing plants aeroponically. Plant
Physiol. 57: 344-346
![]()
Links Mikoriza